

01
「核酸医薬」
これまでの医薬品では治療が難しかった病気に光を灯す新たな医薬品として、注目を集めている核酸医薬。
近年は日本でも研究開発が盛んに行われ、神戸医療産業都市の進出企業や研究機関、大学等でもさまざまな取り組みが始まっています。
ここでは、核酸医薬の特徴や開発の現状などについて見ていきます。
1
核酸医薬(nucleic acid therapeutics)は、生物の遺伝情報を担っている核酸という物質を利用し、化学合成によって作られる医薬品です。現在使われている医薬品の大部分を占める低分子医薬や、がん治療などに用いられる抗体医薬とは作用のメカニズムが異なることから、従来の医薬品では治療が難しかった加齢黄斑変性症※1などの遺伝性疾患や脊髄性筋萎縮症※2といった希少疾患、がんに対する新たな治療手段として期待されています。
人間をはじめとするあらゆる生物の細胞の中にある核酸は、生物が細胞を作り出すために欠かせない物質です。遺伝情報を記録するDNAと、遺伝情報を伝達し細胞の原材料となるタンパク質を合成するRNAで構成され、この2つの働きによって新しい細胞が生まれます。
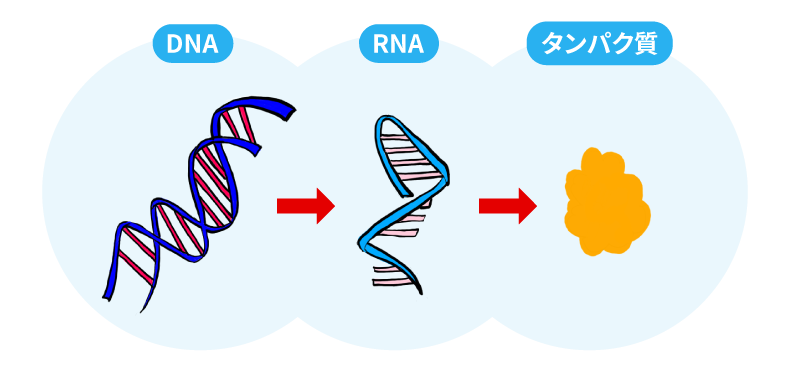
お母さんのお腹の中で赤ちゃんが発育するプロセスでは、DNAに記録された膨大な遺伝情報の中から各身体部位や臓器の形成に必要なデータが抜粋され、情報の伝達を担当するメッセンジャーRNAに転写されます。そして、メッセンジャーRNAの遺伝情報を読み取ってタンパク質を合成し、脳や手などが形作られ、人間らしい姿へと成長していきます。
核酸医薬はこのような仕組みに着目して開発されました。人工的に作ったDNAやRNAを薬として体内に投与し、病気の原因となる遺伝情報を伝達するメッセンジャーRNAを分解したり遺伝情報の読み取りエラーを引き起こしたりしてタンパク質の合成を防ぎ、病気の抑制や治療を行います。
2
核酸医薬の研究開発や市場は、長く欧米がけん引してきました。中でもアメリカは他国を大きくリードし、脊髄性筋萎縮症の治療薬「スピンラザ®」(一般名:ヌシネルセンナトリウム)や急性肝性ポルフィリン症※3の治療薬「ギブラリー®」(一般名:ギボシラン)など、現在流通している核酸医薬の多くを手掛けています。また世界に先駆け、個々の患者さんの病状に応じて核酸医薬を製造し病気を治療する個別化医療も始まり、遺伝性の神経難病であるバッテン病に対して2018年に初めて実施しました。
核酸医薬では現在、がん細胞をターゲットとした開発に力点が置かれており、がん治療の選択肢を広げる可能性があります。その将来性に多くの業界が関心を寄せ、味の素や日東電工なども独自技術を強みに関連事業へ参入しています。
今後核酸医薬の市場規模はさらに拡大すると予測されていて、2021年には核酸医薬を含むバイオ医薬は約5000億円の世界市場となり、2030年ごろまで年率8%程度で成長するとの見方もあります。(参考資料1)
3
核酸医薬のメリットは主に、①抗体医薬より安価に製造できる、②効率良く短期間で薬が完成する、③高い効果が期待できる、などが挙げられます。
①抗体医薬より安価に製造できる
低分子医薬と同じように化学合成で製造できる核酸医薬は、製造に動物などの細胞を用いる抗体医薬と比べると設備費や原材料費を抑えられ、比較的安価に作ることが可能です。
②効率良く短期間で薬が完成する
病気に関連する遺伝子の配列が分かれば、それを基にコンピュータを用いて容易に薬を設計できるのが核酸医薬の大きな特徴です。このような技術革新により、新薬が完成するまでの期間が、年単位から数か月単位へと大幅に短縮されました。
③高い効果が期待できる
従来の低分子医薬では病気の原因物質を狙い撃ちすることが困難でしたが、核酸医薬は病気の原因となる異常な遺伝子に狙いを定めて作用するため効果が得られやすく、薬の影響が広範囲に及ばないことから身体への負担が軽減できると考えられています。
このように核酸医薬はメリットが多い反面、いくつかのデメリットもあります。
最大の弱点は、体内の分解酵素の働きにより分解されやすく、薬の効果が十分に発揮されにくいことです。人間の身体には、病原菌などの異物が侵入した際に防御の役割をする分解酵素のヌクレアーゼが備わっており、核酸医薬を異物と認識して分解してしまうのです。
また、副作用が少ないと言われる一方で臓器障害なども確認されていることから、安全性を疑問視する声も出ています。
このような課題を解決するため、医薬品の有効成分を体内の適所に効率的に送り届けるドラッグデリバリーシステム(DDS)や副作用に対するさまざまな研究開発が行われています。
4
核酸医薬には6種類あり、標的や作用のメカニズム、構造の違いによって、アンチセンス、siRNA、miRNA、アプタマー、デコイ、CpGオリゴに分類できます。
細胞の内側で作用するアンチセンス、siRNA、miRNAは、ターゲットのRNAに結合して病気の原因となるタンパク質の合成を妨げたり、病気を抑制・治療する機能的なタンパク質を増加させたりします。
デコイも細胞の内側で作用し、病気の原因となるタンパク質と結合することにより、遺伝情報の転写を抑制します。
またアプタマーは、細胞の外側で作用して病気を引き起こすタンパク質に結合し、その機能を阻害します。
CpGオリゴも細胞の外側で作用し、標的となるタンパク質と結合することで自然免疫※4を活性化させ、病気の改善につなげます。
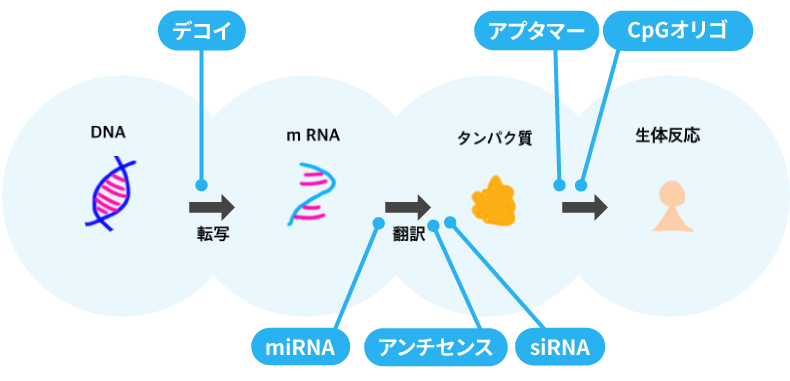
このうち、アンチセンス、siRNA、アプタマー、CpGオリゴが実用化されており、治療に使われています。
5
現在、国内外で16品目の核酸医薬が承認を受け、うち7品目が日本の市場で販売されています(2023年11月時点)。(参考資料2)
歴史をさかのぼると、世界で初めて核酸医薬が承認販売されたのは1989年。ノバルティス社(スイス)などが開発した「ビトラベン®」(一般名:ホミビルセン)で、エイズ患者向けの結膜炎治療薬として使用されました(現在は販売中止)。
日本で最初に承認された核酸医薬は「マクジェン®」(一般名:ペガプタニブ)です。加齢黄斑変性症の治療薬として2008年に使用が始まりました。
国産初の核酸医薬は、日本新薬が手掛けた「ビルテプソ®」(一般名:ビルトラルセン)です。2020年の発売以降、遺伝性疾患であるデュシェンヌ型筋ジストロフィー※5の治療に使われています。
臨床試験の最終段階には、現在、サノフィ社(フランス)が開発中の希少血液疾患の血友病※6に対する新薬「フィツシラン®」などが入っており、今後の進展に注目が集まっています。(参考資料3)
6
核酸医薬の開発製造において日本は欧米に後れをとっているものの、近年は国内の大手製薬企業やバイオベンチャー、大学等で積極的な動きが見られるようになりました。
神戸医療産業都市では、ドイツ製薬大手のベーリンガーインゲルハイムが、同社で実験施設をもつ研究開発拠点としてはアジアで唯一となる「神戸医薬研究所」に、核酸医薬も含めた液剤の製剤化研究を行う研究設備を導入し、新薬の創出に力を注いでいます。
また、2015年に設立した日本核酸医薬学会は、甲南大学ポートアイランドキャンパス内に事務局を設置し、産学官の連携による核酸医薬の発展に努めています。
日本発の研究シーズを一つでも多く社会実装につなげるため、これからも研究者や技術者たちの努力が続きます。