先端医療研究センター老化機構研究部
研究者 / 研究内容
老化の仕組みを解明し、健康寿命の延伸をめざす
老化は加齢に伴う疾患の共通、かつ最大のリスク因子であり、癌や心臓病、認知症、脳血管障害などの死に至る病と深く関連しています。よって老化のメカニズムを解明し、老化を制御する方法を開発することは加齢関連疾患克服の根本的な課題と言えます。我々は世界で広く利用されている老化モデルマウス(α-klotho変異マウス)を開発し、加齢疾患の発症機構の解明を進めています。また、抗老化遺伝子サーチュインを発見し、サーチュインが老化を遅らせ、寿命を伸ばす機構を解析しています。驚いたことに最近の我々の研究結果は老化を遅らせ、寿命を延ばすことも夢ではないことを示唆しています。我々は生命の糸を紡ぐ女神の名前に由来するクロトー遺伝子、抗老化遺伝子サーチュインの解析を中心に老化疾患の発症メカニズムの解明と老化を抑える方法論の開発に取り組み、老化と加齢疾患の克服を目指します。

老化機構研究部長鍋島 陽一(なべしま・よういち)

- 研究内容
- 業 績
研究内容
- 1)老化モデルマウス(α-klotho変異マウス)の解析による加齢疾患の発症機構の研究
- 我々が開発した老化モデルマウスでは、動脈硬化、異所性石灰化、肺気腫、皮膚の老人性萎縮、難聴、不妊、短命等の多彩なヒトの老化疾患に類似の症状が観察されます。老化モデルマウスの原因となっている遺伝子を同定し、α-klothoと名付けました。その後の解析によりα-klothoは電解質代謝の制御因子であることが明らかとなりました。即ち、α-klotho は細胞膜上でFGF23、FGFR1と複合体を形成し、腎臓におけるビタミンD合成、リンの再吸収を抑える働きをします。また、細胞内のα-klotho はNaK-ATPaseと結合し、細胞外カルシウム濃度の低下に応答して細胞表面へと移動し、結果として起こる細胞膜におけるNa+の濃度勾配、膜電位の変化が脈絡叢における脳脊髄液へのカルシウムの移送、腎尿細管におけるカルシウムの再吸収、副甲状腺におけるPTHの分泌を誘導します。α-klothoのこれらの機能はいずれも電解質代謝の制御に関わるものであり、老化モデル(α-klotho変異マウス)では、これらの機能が異常となり、電解質を正常に維持することができません。
次いで、これらの因子に作用して加齢疾患類似症状を抑える分子の解析を進め、ビタミンD活性、血清リン濃度の正常化、Calpain1阻害剤の投与、抗酸化、抗炎症作用を示す化合物の投与により老化関連症状が改善することを確認しました。これらの事実は老化関連症状の改善には幾つかのターゲットがあることを示唆しており、老化症状の克服、健康長寿の実現を展望させるものと考えています。
- 2)α-klotho変異マウスにおける脂質代謝、糖代謝の変容について
- α-klotho変異マウスで観察される多彩な老化疾患類似症状は上記の電解質を中心とする変容だけでは説明できません。その要因として糖代謝の変容、脂質代謝の変容が観察されます。
α-klotho KOマウスでは低トリグリセリド血症が観察されます。血中トリグリセリド濃度は、肝臓での生合成と血中リポタンパク質の取り込みのバランスにより規定されていますが、α-klotho KOマウスでは、肝臓へのリポタンパク質の取り込み亢進、肝臓における脂質の異化経路の顕著な亢進、さらに小腸、糞便への排出亢進が起こっており、低トリグリセリド血症を引き起こしていると推定されています。
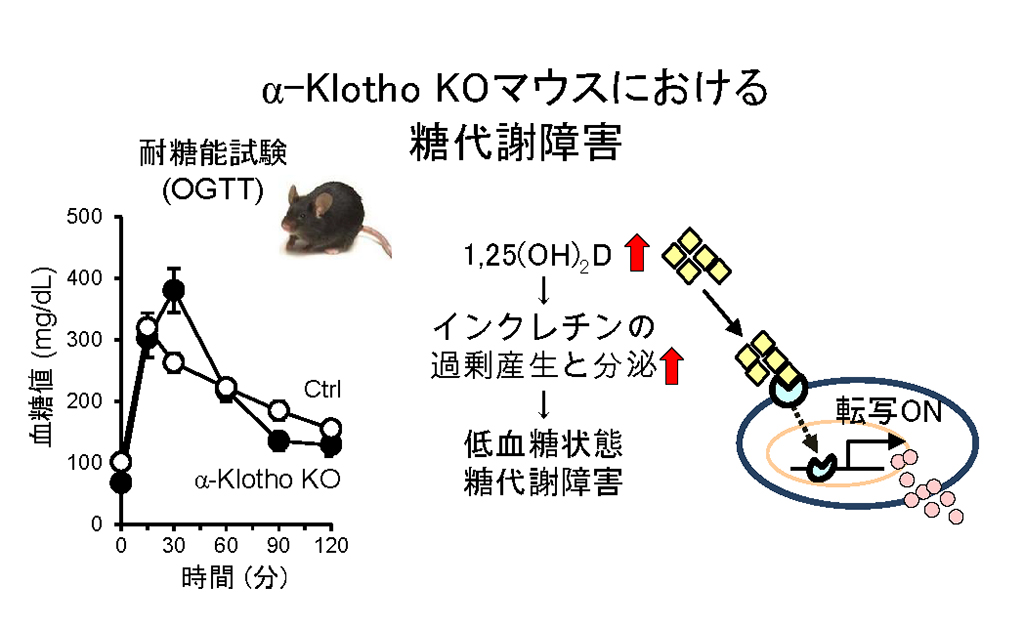
近年ヒトの糖代謝異常と活性型ビタミンD (1,25(OH)2D)濃度を検討した複数のコホート研究報告の中で、糖尿病や老化が進んだ状態ではビタミンD量が減少していることや、加齢に伴って低下した活性型ビタミンD濃度と糖尿病の発症リスクが有意に相関することが示されています。これらの事実は、老化や糖尿病の発症・進展に活性型ビタミンDが重要な役割を果たしており、ビタミンDシグナルが小腸から分泌されるインクレチンやインスリン分泌の制御、糖代謝に深く関わっていることを強く示唆しています。
α-klotho 変異マウスでは活性型ビタミンDが亢進していることから、腸管におけるL,K細胞を単離して解析したところ、インクレチン(GLP-1,GIP)が過剰生産されていることが判明しました。また、糖負荷試験において、α-klotho 変異マウスでは、上昇した血糖値が野生型マウスに比して速やかに低下することが判明し、この急速な低下には過剰なインクレチンの産生と分泌促進、並びにビタミンDの機能亢進が関わっていることが示唆されました。さらに、野生型マウスに活性型ビタミンDを投与するとグルコース応答性のインスリン分泌が一過性に増強され、この増強にはインクレチンの亢進が寄与していることを示す結果が得られました。これらの結果は、ビタミン Dシグナルが小腸と膵臓においてGLP-1、GIP産生細胞に作用し、その発現、分泌の調節に関与していることを示しています。現在、小腸と膵臓のインクレチン産生細胞において、ビタミンDシグナルが遮断されたモデルを作製し、解析を行っており、その病態や糖代謝とインクレチン制御機構を詳細に解析することにより、血糖値制御の新規ターゲットを提案、糖代謝制御におけるビタミンDシグナルの新しい役割、機能を明らかにしたいと考えています。
- 3)糖尿病モデルマウスを用いた膵臓β細胞の増殖とその制御因子の研究
- 2型糖尿病の患者人口が急増加し、深刻な問題となっています。そこで、糖尿病の原因であるβ細胞の減少(インスリン不足)を補うために、糖尿病モデルマウス(ICER-Tg糖尿病マウス、β細胞の減少により高血糖、糖尿病を発症します)を用いて、新しいβ細胞を体内で増加させる因子の探索に取り組んでいます。これまで、β細胞は脆弱で一旦死滅したら再生・増殖しにくいと考えられてきましたが、我々は糖尿病モデルマウスにおいて性ステロイドホルモンを亢進させるとβ細胞量が急激に増加し、血糖値が正常化することを見出しました。この現象に大きく関わる新規遺伝子の探索を行い、β細胞を増殖誘導すると推測される因子を突き止めました。さらに、この因子の発現タイミングや発現量の変動を詳細に解析したところ、細胞増殖を止める役目を果たすと報告されている増殖抑制因子がこの増殖停止のタイミングに合わせて発現誘導されることも突き止めました。これら遺伝子の機能を詳細に解析することにより、β細胞が新生誘導される機構を解明し、新規糖尿病治療法の開発に貢献したいと考えています。
- 4)β-Klotho/FGF15システムによる脂質代謝の制御の研究
- α-Klothoのホモログとして同定されたβ-Klothoは、肝臓において小腸から分泌されるFGF15のシグナルを媒介することで胆汁酸合成経路の律速酵素であるCYP7A1の遺伝子発現を抑制し、胆汁酸生合成を負に制御しています。
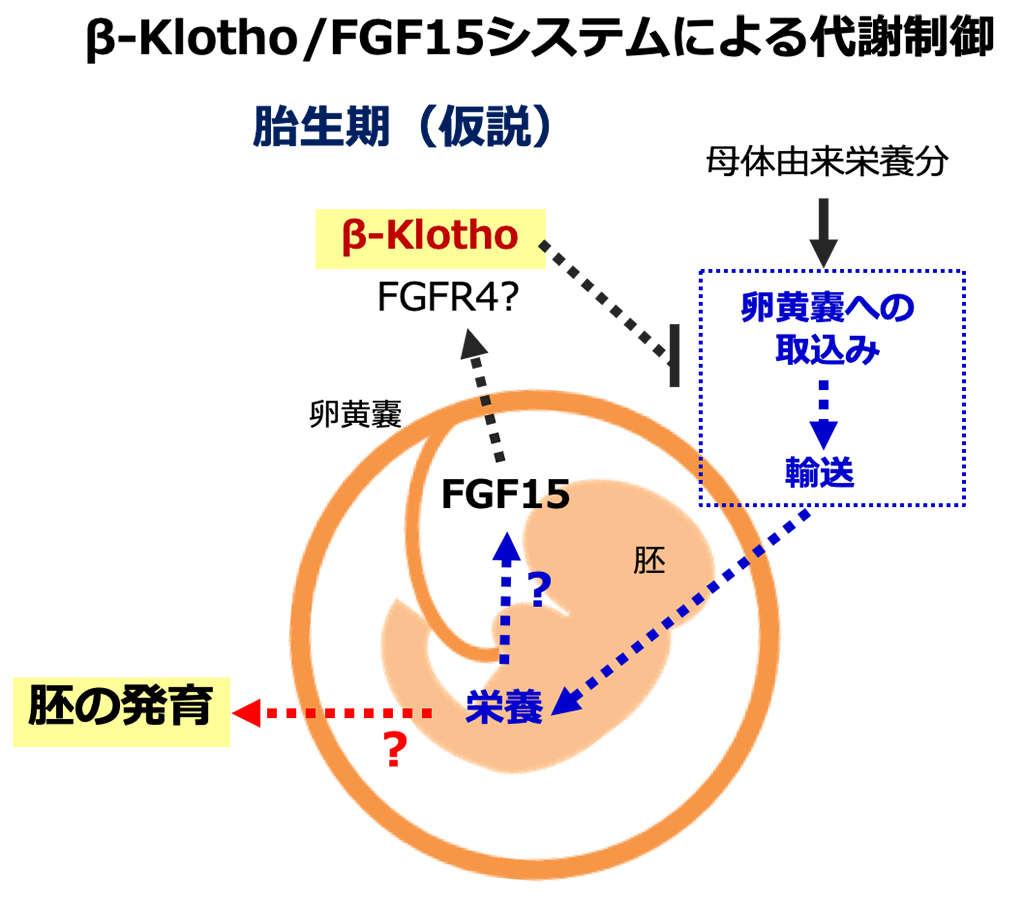
一方、胎生期において、β-klothoは卵黄嚢に強く発現しており、Fgf15は胚の脳および神経管に高発現し、興味深いことに、β-klotho欠損胚とFgf15欠損胚はともに発育抑制を示します。卵黄嚢は胎盤が完成するまで母体から胚への栄養供給を担う器官であることから、β-Klotho/FGF15システムによる標的分子の制御が胚の発育に関わる可能性が考えられ、解析を進めました。まず、RNAシーケンス法により、卵黄嚢でβ-klotho依存的に発現が変化する遺伝子のリストを作成しました。ついで、標的分子の挙動はβ-klotho欠損卵黄嚢とFgf15欠損卵黄嚢で一致すると考えられるため、定量PCR法でFgf15欠損卵黄嚢における標的分子候補の遺伝子発現を確認し、β-Klotho/FGF15システムに非依存的な分子はリストから除外し、栄養の取込み・輸送に関わる遺伝子の発現がβ-klotho・Fgf15依存的に卵黄嚢で変化することを見出しました。実際に、組織学的解析においてβ-klotho欠損卵黄嚢、Fgf15欠損卵黄嚢において同定された候補分子により制御を受けると推定される栄養素の蓄積が認められました。以上の結果から、β-Klotho/FGF15システムが卵黄嚢を介した母体から胚への栄養供給を制御していることが示唆されました。
子宮内での胎児の発育不良は糖尿病や脂質異常症などの代謝疾患リスクを高めることが知られていますが、胎児の発育を制御するメカニズムには不明な点が多く、本研究で得られた知見は、子宮内の胎児の発育遅延メカニズムの解明だけでなく、代謝疾患に対する新しい予防戦略の立案にも役立つことが期待されます。
- 5)サーチュイン1、NAD/NMNの機能解析による老化の分子機構の研究
- ⽼化機構研究部今井研究室においては、以下の⼆つの項⽬を⽬的として、哺乳類における⽼化•寿命の制御機構を明らかにすべく研究を推進しています。
1)視床下部背内側核(DMH)に存在し、哺乳類の⽼化•寿命制御に重要な役割を果たしている特定のニューロンを遺伝学的に制御し、末梢臓器の⽼化に与える影響、および最終的には寿命に与える影響を解析し、その詳細な分⼦機構を解明する。
2)主要NAD+合成中間体であるnicotinamide mononucleotide (NMN)の抗⽼化作⽤メカニズムを明らかにし、薬理学的な⽼化•寿命制御の⽅法論を開発する。
これらの⽬的の達成に向け、まず、DMH における SIRT1/NKX2-1-double positive neurons の臓器・個体⽼化制御における重要性を明らかにするため、この神経細胞群に特異的に発現している遺伝⼦ Prdm13 とPpp1r17 に関して、その蛋⽩質が当該神経細胞群に確実に局在していることを確認し、これらの遺伝⼦群の特異的発現を利⽤した解析を続けています。また当該神経細胞群における単⼀神経細胞の活動を直接的に記録できる電気⽣理学的解析法も合わせて確⽴しました。興味深いことに、これらの神経細胞は NAD+合成中間体であるNMN の投与に反応して、神経活動が上昇することが明らかになりつつあります。特に、脳波の測定においては、NMN 投与後1−2 分の間に、デルタ波(0.5−4Hz)の減弱、ガンマ波1(30−58Hz)、ガンマ波3(60−140Hz)の増⼤が⾒られ、その後にデルタ波が増強されるというパターンが観察されています。このパターンは1時間のうちに2−3回繰り返され、⼀⾒ REM 睡眠のパターンに類似していますが、詳細な解析は、これからの研究課題となっています。
⼀⽅、視床下部の各部において⽼化に伴う NAD+の変化を正確に測定するためにLaser-captured microdissection microscope と HPLC を組み合わせた新規の測定⽅法を確⽴しました。現在、DMH など視床下部の各部位において測定を続けています。同時に、これらの各部位において、⽼化に伴う炎症性の変化の検討も⾏っており、それらの変化が NMN トランスポ ーターの発現に影響を与えているかどうかを検討中です。
これらの成果に加えて、NMNの合成酵素であり、⾎液循環中に分泌されている extracellular NAMPT(nicotinamide phosphoribosyltransferase; eNAMPT)が、細胞外小胞(エクソーム)に包まれて分泌され、視床下部に到達し、シグナルを伝えること、若いマウスの血中にはエクソームに包まれたeNAMPTが多量に存在し、そのエクソームを採取し、老化マウスに投与すると老化症状が軽減し、若返りを示し、さらに寿命が顕著に伸びることが確認され、エクソームに包まれたeNAMPT が⽼化•寿命の制御に⾮常に重要な役⽬を果たしていることを証明しました(Yoshida et al. Cell Metab.2019)。
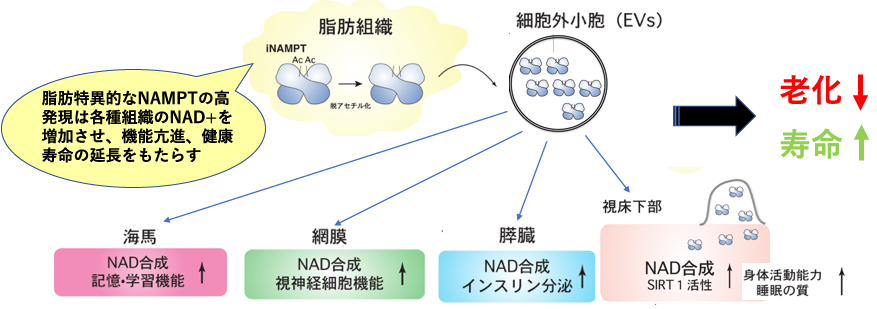
さらにワシントン⼤学医学部の今井研究室において、新規の NMNトランスポーターを同定、小腸に大量に発現しており、NMNの吸収、NMN投与に伴うシグナル伝達に重要な働きをしていることを明らかにしました(Grozio et al., Nat. Metab. 1: 47-57, 2019)。この結果から、抗⽼化物質として注⽬されるNMN の中枢性機能が解明されることが期待され、NMN の社会実装に向けた理論的基盤が確⽴されるものと考えています。
業績
- Tanaka S., Senda N., Iida A, Sehara-Fujisawa A., Ishii T., Sato F., Toi M., Itou J.
In silico analysis-based identification of the target residue of integrin α6 for metastasis inhibition of basal-like breast cancer. Genes to Cells in press (2019) - Kanatsu-Shinohara M, Yamamoto T, Toh H, Kazuki Y, Kazuki K, Imoto J, Ikeo K, Oshima M, Shirahige K, Iwama A, Nabeshima Y, Sasaki H, Shinohara T. Aging of spermatogonial stem cells by Jnk-mediated glycolysis activation. Proc Natl Acad Sci USA Jul29.doi:10.1073/pnas.1904980116. (2019)
- Miyoshi C, Kim SJ, Ezaki T, Ikkyu A, Hotta-Hirashima N, Kanno S, Kakizaki M, Yamada M, Wakana S, Yanagisawa M, Funato H. Methodology and theoretical basis of forward genetic screening for sleep/wakefulness in mice. Proc Natl Acad Sci USA. Jul 23. pii: 201906774. doi:10.1073/pnas. 1906774116. (2019)
- Kitaura F, Yuno M, Fujita T, Wakana S, Ueda J, Yamagata K, Fujii H.Normal B cell development and Pax5 expression in Thy28/ThyN1-deficient mice.PLoS One. 2019 Jul 22;14(7):e0220199. (2019)
- Yoshida, M., Satoh, A, Lin, J. B., Mills, K. F., Sasaki, Y., Rensing, N., Wong, M., Apte, R.S., Imai, S. 2019. Extracellular vesicle-contained eNAMPT delays aging and extends lifespan in mice.
Cell Metab. 2019 Jun 7. pii: S1550-4131(19)30255-4. doi: 10.1016/j (2019) - Kawauchi T., Nabeshima Y. Growth arrest triggers extra-cell cycle regulatory function in neurons: possible involvement of p27kip1 in membrane trafficking as well as cytoskeletal regulation. Frontiers Cell and Developmental Biology 2019 Apr 26;7:64. doi: 10.3389/fcell.2019.00064. eCollection (2019)
- Komura H, Kakio S, Sasahara T, Arai Y, Takino N, Sato M, Satomura K, Ohnishi T, Nabeshima Y, Muramatsu SI, Kii I, Hoshi M. Alzheimer Aβ Assemblies Accumulate in Excitatory Neurons upon Proteasome Inhibition and Kill Nearby NAKα3 Neurons by Secretion. iScience. 13:452-477 (2019)
- Grozio, A., Mills, K. F., Yoshino, J., Bruzzone, S., Sociali, G., Tokizane, K., Lei, H. C., Cunningham, R., Sasaki, Y., Migaud, M. E., Imai, S. Slc12a8 is a nicotinamide mononucleotide transporter.
Nat. Metab. 1: 47-57. (2019) - Shikanai M. Nishimura Y.i V, Sakurai M., Nabeshima Y., Yuzaki M., Kawauch T. Caveolin-1 promotes early neuronal maturation via caveolae-independent trafficking of N-cadherin and L1. iScience 7:53-67. (2018)
- Fujiyama T., Miyashita S., Tsuneoka Y., Nagaoka M., Kakizaki M., Kanno S., Ishikawa Y., Kawaguchi Y., Yanagawa Y., Magnuson MA., Nabeshima Y., Masashi Yanagisawa M., Funato H., Hoshino M. Forebrain Ptf1a is required for sexual differentiation of the brain. Cell Reports 24 (1):79-94. (2018)
- Awano H. Matsumoto M., Nagai M., Taku Shirakawa T., Maruyama N., Iijima K., Nabeshima Y., Matsuo M. Diagnostic and clinical significance of the titin fragment in urine of Duchenne muscular dystrophy patients. Clinica Chimica Acta; 476, 111–116 (2018)
- Shikanai M, Yuzaki M, *Kawauchi T. “Rab family small GTPases-mediated regulation of intracellular logistics in neural development” Histol. Histopathol. Vol.33 (8) 765-771. (2018)
- Yoshino, J., Baur, J.A., Imai, S. NAD+ intermediates: The biology and therapeutic potential of NMN and NR. Cell Metab. 27: 513-528. (2018)
- Johnson, S, Wozniak, D. F., Imai, S. Hippocampus-dependent cognitive phenotypes in old mice are recapitulated by CA1-specific Nampt knockdown and improved by nicotinamide mononucleotide. NPJ Aging Mech. Dis. 4:10. doi: 10.1038/s41514-018-0029-z (2018)
- Snyder-Warwick, A. K.*, Satoh, A., Santosa, K. B., Imai, S., Jablonka-Shariff, A. Hypothalamic Sirt1 protects terminal Schwann cells and neuromuscular junctions from age-related morphological changes. Aging Cell May 30: e12776.(*Correspondence) (2018)
- Johnson, S. and Imai, S. NAD+ biosynthesis, aging, and disease. F1000Res. 7:132. doi: 10.12688/f1000research.12120.1. (2018)
- Yoshida, M. and Imai, S. Regulation of Sirtuins by Systemic NAD+ Biosynthesis. Introductory Review on Sirtuins in Biology, Aging, and Disease, 1st Edition, edited by Leonard Guarente, Raul Mostoslavsky, and Aleksey Kazantsev. Academic Press, USA, (2018)
- 西村嘉晃、*川内健史 「薬理学的アプローチによる大脳皮質形成における神経細胞移動の分子機構の解明」 日本薬理学雑誌 (2019) Vol.153 (4) 167-171.
- 鍋島陽一 個体老化、細胞老化研究の最近の進歩 特集/老化と糖尿病・代謝疾患 内分泌・糖尿病・代謝内科 46(1)巻 2018年1月号 53−60ページ (2018)
- 鍋島陽一 AMED 老化研究推進・支援拠点が果たす役割 日本臨床 2018年6月増刊号
老年医学・老化研究の展望 - 鍋島陽一 個体老化、細胞老化研究の最近の進歩 Dojin news:167, 1-6 (2018)
学会・シンポジウム等における⼝頭・ポスター発表
シンポジウム/招待講演
- 鍋島陽一 老化研究の最近の進歩ー健康長寿は実現可能な目標となっているー津和野シンポジウム(2019年7月27日、津和野)
- 若菜茂晴 マウスの表現型解析情報を正しく得るためには” ワークショップ 3 データサイエンスと行動解析技術の融合と展望 第46回日本毒性学会(2019年7月25~27日、徳島)
- 鍋島陽一 老化研究の最近の進歩ー健康長寿は実現可能な目標となっているーオリエンタル酵母シンポジウム特別講演(2019年7月12日、東京)
- 稲田明理 骨格筋の糖取り込みにおける性ステロイドホルモンの役割 分子骨格筋代謝研究会(2019年7月、京都)
- 若菜茂晴 「⽼化・寿命研究の推進と加齢マウス」 第66回日本実験動物学会総会 ランチョンセミナー(2019年5月16日)
- 川内健史 “脳構築と老化における細胞周期関連分子の細胞周期非依存的な役割”、第10回 Gタンパク質Meeting(2019年4月20-21日、山形大学医学部)
- 稲田明理 膵β細胞の新生・増殖誘導とその制御因子内分泌・代謝学共同利用・共同研究拠点セミナー 生活習慣病解析プロジェクト共催群馬大学生体調節研究所(2019年4月、前橋)
- 鍋島陽一 KlothoとFGF23、FGF15による代謝の恒常性制御 第91回日本内分泌学会学術総 シンポジウム「FGFsと生体制御」(2018年4月26日、シーガイア宮崎)
- 鍋島陽一 健康長寿の実現を目指した老化研究の推進 第65回日本実験動物学会総会学術集会委員会シンポジウム、健康長寿と老化研究の課題(平成30年5月17日、富山)
- 鍋島陽一 α-Klothoの機能と病態における意義 29回Forum in Dojin 細胞と個体の老化生物学(2018 平成30年11月22日、熊本)
- 川内健史 “神経成熟の初期段階におけるカベオラ非依存的なCaveolin-1の役割” 蛋白研セミナー「高次脳機能の神経回路機構」、大阪大学蛋白質研究所(2018年11月26-27日、大阪)
- Takeshi Kawauchi, Mima Shikanai, Michisuke Yuzaki, Yo-ichi Nabeshima. “In vivo roles of clathrin-independent endocytosis in early neuronal maturation” Cold Spring Harbor Asia (CSHA) meeting of “Latest Advances in Development & Function of Neuronal Circuits”, Awaji Yumeburai Conference Center, Japan. September 25-28, 2018.
- Takeshi Kawauchi, Mima Shikanai, Yoshiaki V. Nishimura, Miwa Sakurai, Mitsunori Fukuda, Yo-ichi Nabeshima, Michisuke Yuzaki. “Clathrin-independent endocytosis regulates neuronal maturation and migration” ISDN 2018 (22nd Biennial Meeting of the International Society of Developmental Neuroscience), Nara, Japan. May 22-25, 2018.
- 稲田明理 「老化モデルにおけるインクレチン産生と糖代謝制御 :臓器相関による生体制御システムとその変容の仕組み」H30年度生理学研究所研究会(岡崎) 9月
- 稲田明理 「膵β細胞の新生・増殖誘導とその制御因子」内分泌・代謝学共同利用・共同研究拠点セミナー群馬大学生体調節研究所(前橋) 4月
- 稲田明理 「骨格筋の糖取り込みにおける性ステロイドホルモンの役割」分子骨格筋代謝研究会(京都) 7月
- Yoshio Endo, Yoshihiro Uto, Yusei shinohara, Chiaki Abe(代理発表), Tohru Obata, Shun-ichiro Ogura, Yutaka Yonemura. ・Overcoming acquired resistance to photodynamic therapy using 5-aminolevulinic acid in gastric cancer cells 学会発表:共第77回日本癌学会学術総会(大阪)
- 遠藤 良夫, 宇都 義浩, 篠原 侑成, 安部 千秋, 小幡 徹, 小倉 俊一郎, 米村 豊.5-アミノレブリン酸を用いるがん光線力学的療法に対する耐性化機構とその克服.日本薬学会第139年会(千葉)
- Imai S. Purdue University, Department of Biochemistry Seminar, February 2018
- Imai S. Medical College of Georgia at Augusta University, Vascular Biology Center, August 2018.
- Imai S. Cell Symposium on Aging and Metabolism, Sitges, Spain, September 2018.
- 今井 眞⼀郎 「健康を考える −⽼化・寿命研究の最前線から⾒た productive aging の実現−」新興和製薬株式会社主催(2018年12月8日、国内)
外部資金による研究状況
- AMED-CiCLEプロジェクト「フレイルの予防薬・治療薬の研究開発」2019年4月1日発足
- 伊藤潤二 科学研究費補助金 基盤研究(C)
- 鍋島陽一 新学術領域(研究領域提案型) 「ステムセルエイジングから解明する疾患原理」領域
平成30(2018)年度 「早期老化マウスにおける幹細胞システムの老化促進と加齢疾患の発症に関する研究」(代表者) - 鍋島陽一 AMED「老化メカニズムの解明・制御プロジェクト」老化研究プロジェクトの統括と推進、ならびに動物実験を中心とする研究・技術支援
- 川内健史 科学研究費補助金 新学術領域 平成29(2017)年度〜平成30(2019)年度 「細胞外環境に応答した段階的スクラップ&ビルドによる樹状突起形成機構の解明」(研究代表者)
- 川内健史 AMED「老化メカニズムの解明・制御プロジェクト」 研究開発拠点「個体・臓器老化研究拠点」(拠点長:片桐秀樹教授) 平成29(2017)年10月〜令和4(2022)年3月 分担研究開発課題名「α-クロトー変異マウスをモデルとした多彩な臓器老化症状の発症要因の解明と制御方法開発への展開」(研究開発分担者)
- 今井眞一郎 AMED「老化メカニズムの解明・制御プロジェクト」 研究開発拠点「個体・臓器老化研究拠点」(拠点長:片桐秀樹教授)
- 稲田明理 文部科学省科学研究費(平成28(2016)年度~平成30(2018)年度)「膵臓β細胞に作用する新たな増殖機構の解明」
- 稲田明理 群馬大学 共同研究拠点(平成28(2016)年度~平成30(2018)年度)「膵島携帯の維持機構の解明」
- 稲田明理 田辺三菱製薬株式会社 共同研究(平成28(2016)年度~平成30(2018)年度) 「ICER-TgマウスにおけるSGLT2阻害薬カナグリフロジンの腎臓および膵臓機能に及ぼす影響に関する研究」
- 小林 加奈子 『β-Klotho/FGF15システムの新規標的分子の同定と胎児発育への寄与の解明』平成28(2016)年度~平成30(2018)年度

