Research focus研究内容
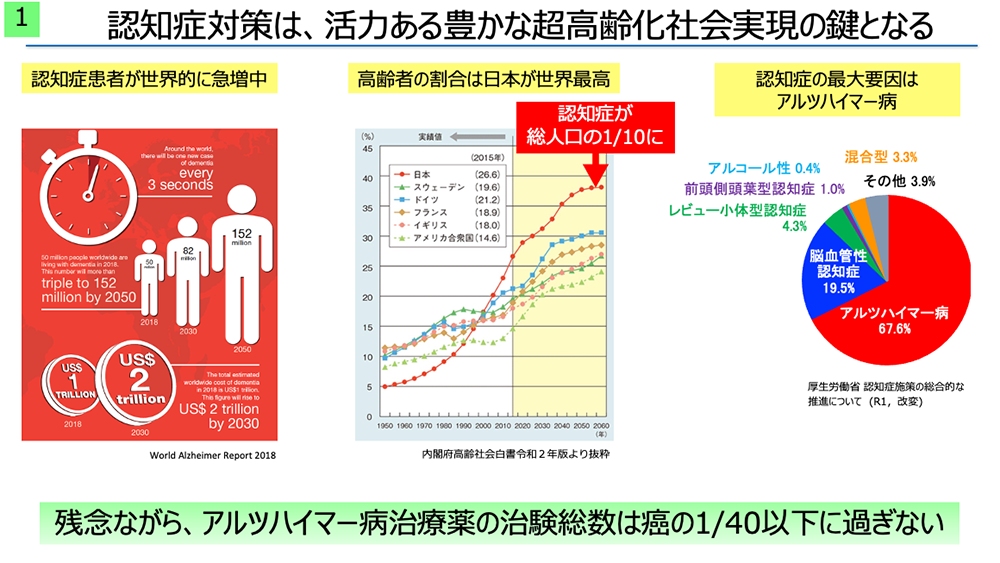
認知症患者は2050年には世界で総数1.5億人を突破すると予想されており(World Alzheimer Report 2018)、その6割以上がアルツハイマー型認知症と言われています。そのため、アルツハイマー病に対する根本的な治療薬が待望されていますが、そもそも臨床治験に至ることすら難しいのが現状です。

臨床開発が進まない理由は様々ですが、主なものとしては、1番目には、アルツハイマー病の定義が実態よりも広すぎる可能性、2番目には、ヒトの主病態は神経細胞脱落ですが、多くの臨床開発では神経細胞脱落を伴わない齧歯類疾患モデルを用いていること、3番目としては、これまで適切な創薬開発ターゲットが選ばれていなかった、ということが課題として挙げられると思います。
上記を踏まえ、1.「ヒトにおける発症の原因」を特定し、ヒトでの発症メカニズムを真に理解し、2.その理解の基に有効な(可能なら低分子)治療薬を開発すること、3.治療に最適な時期を特定し効果を判断するための診断系を開発すること、が必要と考えています。特に、アルツハイマー病の特徴である、大脳皮質の特定の層が脱落する皮質層状変性が起こる分子メカニズムを理解し、それに基づく早期治療法開発が必要と考えています。
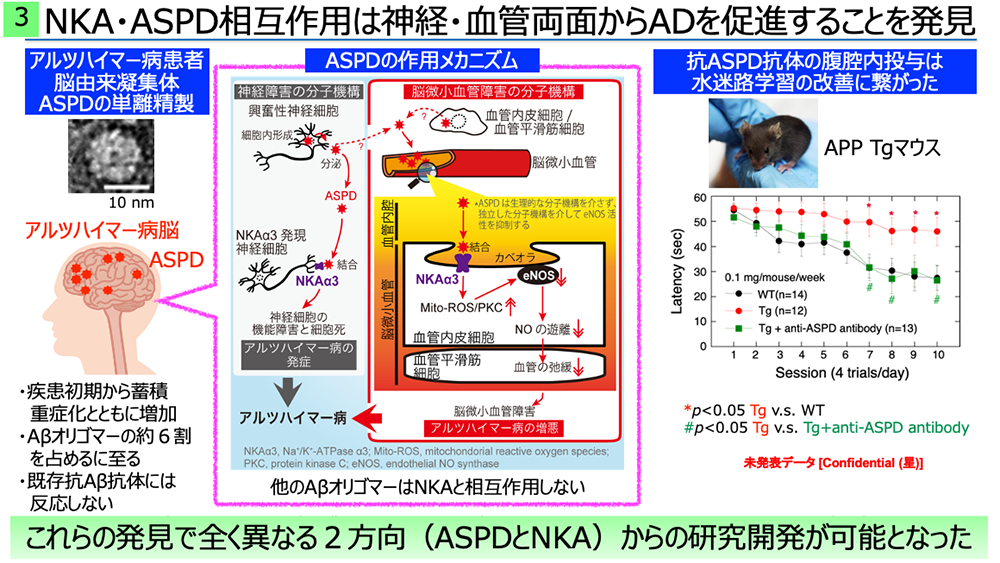
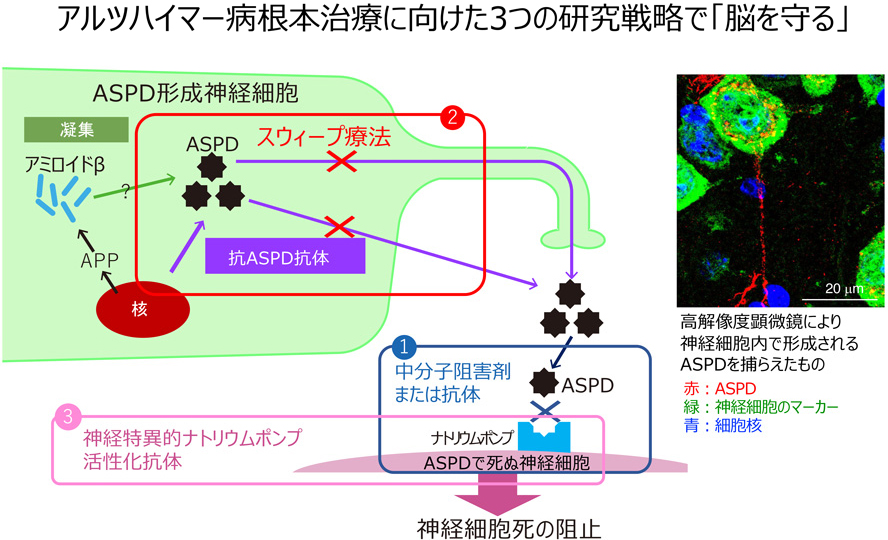
アルツハイマー病は、シナプス変性を経て、成熟神経細胞が死に至り発症します。その原因と見なされてきたアミロイドβ蛋白質(Aβ)は、生理的に若い時から作られていますが、アルツハイマー病ではAβが集合体を作ることで毒性を発揮するようになると考えられてきました。しかしながら、Aβはフレキシブルな性質を持ち10種類以上の構造を取るため、集合体についても様々な種類が報告されており、そのいずれが本当に患者の脳に存在するのか、そしていかにして神経細胞を障害するのかは良く解っていませんでした。我々は、まず、Aβがどう集合すると最も毒性が強くなるかを明らかにし、その最も毒性が強い構造体に対する選択的抗体を創ることで、患者脳から、初めてヒト成熟神経細胞に死をもたらすAβ集合体「アミロスフェロイド(ASPD)」を単離することに成功しました(Hoshi et al. Proc. Natl. Acad. Sci. USA 100, 6370-6375. 2003、Noguchi et al. J. Biol. Chem. 284, 32895-32905. 2009)。ASPDは約30個のAβが集合し規則性のある安定した立体構造を取っており(Matsumura et al. J. Biol. Chem. 287, 15947-15958. 2012)、しかも、それはASPDに特異的な構造であることが解りました(Ohnishi et al. Proc. Natl. Acad. Sci. USA. 112, E4465-E4474. 2015)。ASPDはこの特異的立体構造を介して、成熟神経細胞にのみ発現し神経の静止膜電位の保持に必須であるα3型ナトリウムポンプ(Na, K-ATPase)(NKAα3)に選択的に結合し、その機能を阻害することで成熟神経細胞の劇的な死を引き起こすことを発見しました(Ohnishi et al. Proc. Natl. Acad. Sci. USA. 112, E4465-E4474. 2015)。興味深いことに、Aβは神経細胞の種類を問わず産生されますが、ASPDは興奮性神経細胞の内部でのみ形成されており、その後細胞外への分泌を介して周囲の成熟神経細胞を死に追いやっていることを解明しました(Komura et al. iScience. 13, 452-477. 2019)。
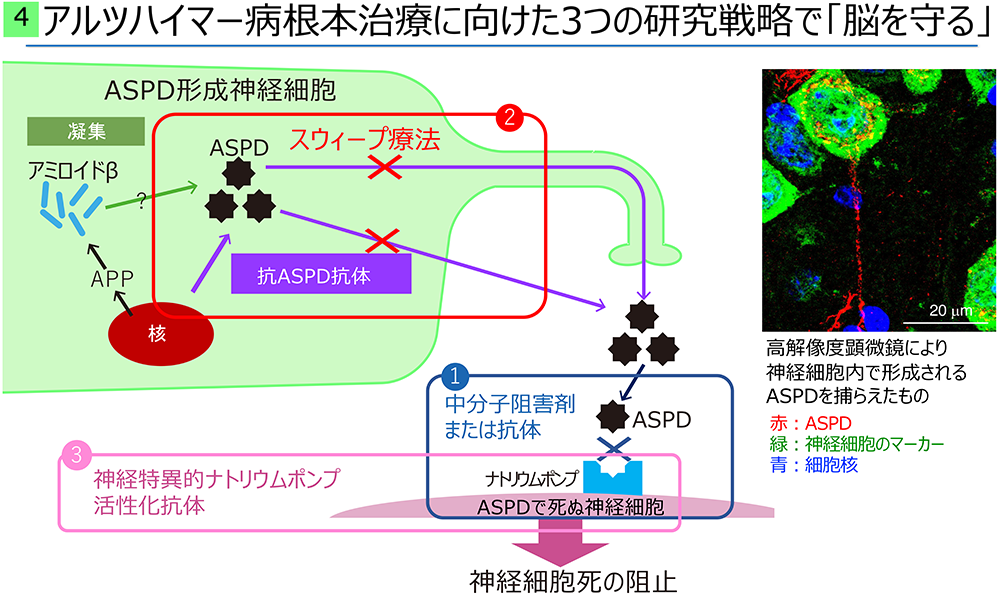
以上の結果に基づき、ASPDとNKAα3の両面から、基礎と応用研究を進めています。
主なプロジェクトとしては、以下の6つになります。
- ・ASPDとNAKα3の結合様式の理解に基づく中分子治療薬の開発
- ・神経細胞内で形成されるASPD除去剤の開発
- ・ナトリウムポンプ運動正常化治療薬の開発
- ・ASPD体外診断薬の開発
- ・病態伝搬と神経ネットワークの関係
- ・脳と血管のクロストーク解明
答えを得るためには、原子レベルから細胞、個体レベルにわたる研究が必要であり、専門分野が異なる研究者達と連携し、技術的な課題をブレークスルーしながら進んでいます。
我々の発見に次いで、NKAα3を介する神経細胞死はアルツハイマー病だけではなくパーキンソン病、筋萎縮性側索硬化症(ALS)でも共通に起こることが報告されました。従って、私たちはアルツハイマー病だけではなく神経変性疾患に共通の新たな経路を見出し、それに対する治療戦略を提示したことになります。
上記の課題をとおして、脳が健全に機能し続けられるように、そのメカニズムを理解し、その理解に基づいて安全で有効な治療方法の開発に貢献していきたいと思っています。