先端医療研究センター脳循環代謝研究部
Research Overview研究概要
脳を治す医療を神戸から世界へ
寝たきりの原因第1位は脳卒中、第2位は認知症であり、現状では、これらの疾患を治す有効な治療法がありません。私たちは、(1)脳梗塞に対する幹細胞投与が、脳梗塞周囲の神経幹細胞活性化を介して神経機能を再生させること、(2)認知症に対する幹細胞投与が、海馬の神経幹細胞活性化を介して神経機能を再生させること、(3)造血幹細胞や間葉系幹細胞を使った幹細胞治療の根本的な作用機序が、ギャップ結合(図1)を介した直接的な細胞-細胞相互作用であることなど、脳神経機能の再生に関する全く新しい知見を、世界に先駆けて次々と発見報告してきました。現在、それらの成果に基づき、脳梗塞および認知症を治す医療を日本から世界へ普及させるための研究開発を行っています。
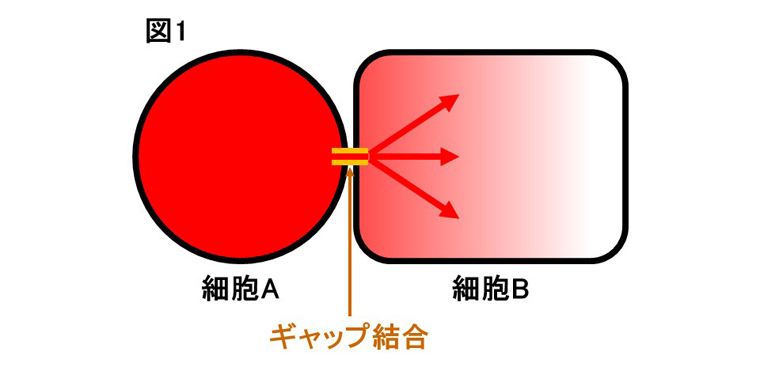
- 図1. ギャップ結合の模式図
- ギャップ結合は接触する細胞同士をつなぐ細胞間トンネルです。細胞の細胞膜にはコネクシンと呼ばれる細胞間トンネルを構成するタンパクが存在し、接触する細胞のコネクシン同士が繋がると、分子量1500以下の小さい分子やイオンは、隣接細胞の細胞質へ濃度勾配に従い自由に通過します。
NEWS
-
29 Aug 2023
-
認知症に対する再生医療研究のインタビュー記事が「日経メディカル」で紹介されました。
- 脳循環代謝研究部長
- Professor
- 田口 明彦
(たぐち あきひこ) - Akihiko Taguchi,M.D., Ph.D.
- @akitaguchi_lab
- taguchi★fbri.org
[★を@に置き換えてください]

- Research focus研究内容
- Publications発表論文
脳血管再生に対する再生医療の確立
(1)これまでの成果
- ・脳梗塞モデルマウスへの幹細胞投与による神経機能再生効果
再現性の極めて高い脳梗塞モデルマウス(Taguchi et al. J Exp Stroke Transl Med. 2010)に対する造血幹細胞投与を行い、幹細胞投与が脳血管再生を促進すること、脳血管再生が脳梗塞により誘導された神経幹細胞の生着に必須であること、幹細胞投与が神経機能再生を促進することを、世界に先駆けて発見報告しました(Taguchi et al. J. Clin. Invest. 2004)(図2)。 - ・脳梗塞患者への幹細胞投与による神経機能再生効果
重症脳梗塞患者に対する自己造血幹細胞投与の臨床試験を行い、幹細胞投与が脳循環代謝および脳神経機能を改善することを発見報告しました(Taguchi et al. Stem Cells Dev. 2015)(図3)。 - ・幹細胞治療の作用機序の同定
脳梗塞患者に対する幹細胞治療の臨床試験で汎用されている造血幹細胞(図4)および間葉系幹細胞(図5)の作用機序が、ギャップ結合を介した直接的な細胞-細胞相互作用であることを、世界に先駆けて発見報告しました(Kikuchi-Taura et al. Stroke 2020、Kikuchi-Taura et al. StemCells 2021)。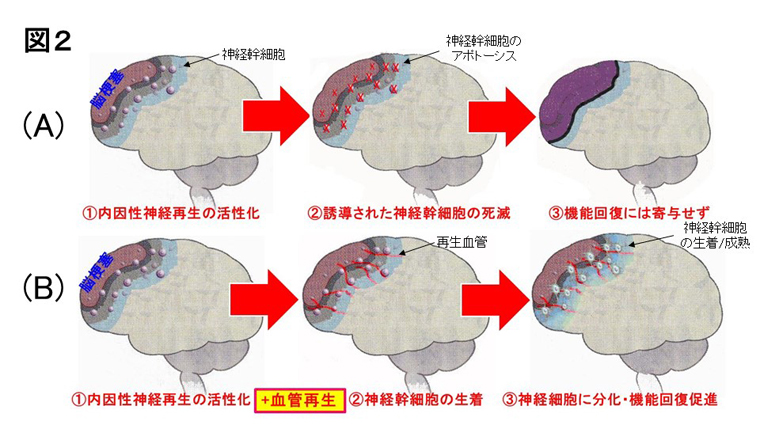
- 図2.脳梗塞後の血管再生による内因性神経再生
- 脳梗塞後には内因性の神経再生が活性化されますが、誘導されてきた神経幹細胞は血管再生がなければアポトーシスでほとんど死滅します(A)。一方、造血幹細胞投与などにより血管再生を活性化すると、誘導されてきた神経幹細胞は生着、成熟、機能し、神経機能向上に寄与することが判りました(B)。(Taguchi et al. J. Clin. Invest. 2004より引用/改変)
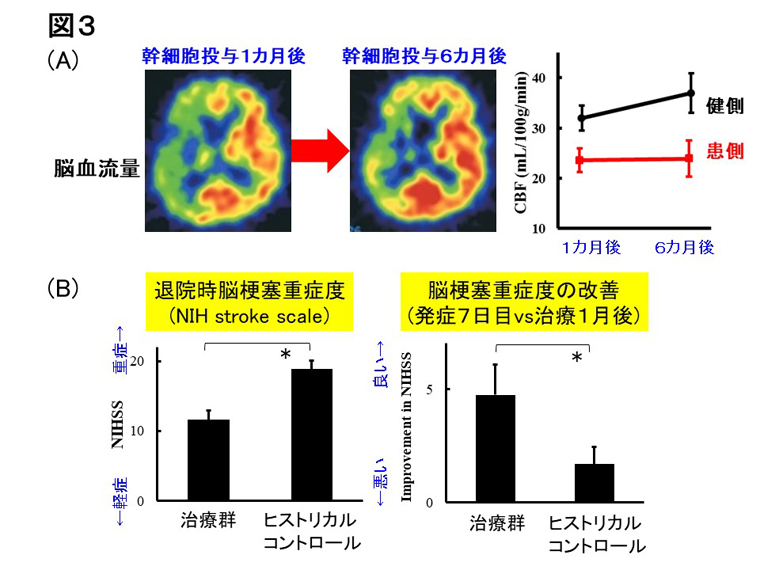
- 図3.脳梗塞患者に対する自己造血幹細胞移植治療による脳循環代謝の改善
- 自己造血幹細胞移植治療により脳血流量(A)(CBF: Cerebral blood flow)や脳酸素代謝量(B)(CMRO2: Cerebral metabolic rate of oxygen)の増加が観察されました。 (Stem Cells Dev. 2015より引用/改変)
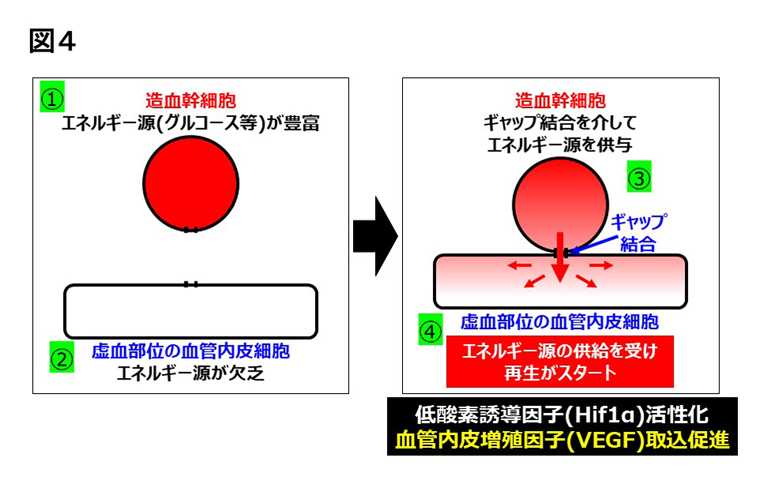
- 図4.造血幹細胞による血管再生促進メカニズムの同定
- 嫌気性代謝のため解糖系基質などのエネルギー源を多く内包する造血幹細胞が、ギャップ結合を介して、障害を受けた細胞にエネルギー源を供与し、血管再生をスタートさせることを同定しました(Stroke 2020より引用/改変)。
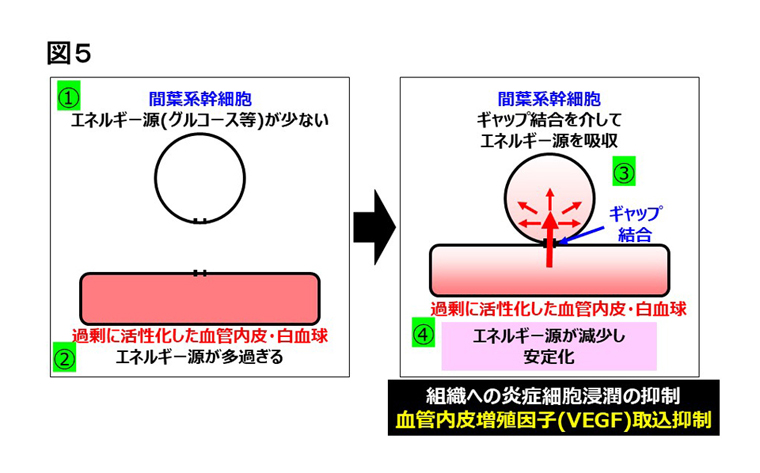
- 図5.間葉系幹細胞の再生促進メカニズムの同定
- 好気性代謝のため解糖系基質などのエネルギー源が少ない間葉系幹細胞が、ギャップ結合を介して、過剰に活性化した細胞からエネルギー源を吸収し、過剰な炎症反応を抑制することを同定しました(StemCells 2021より引用/改変)
(2)研究の内容
- ①最適化した幹細胞治療の産業化
現状の幹細胞治療は、効果が不確実でかつ非常に高額であるため、一般的な医療としては普及していません。幹細胞治療の根本的な作用機序がギャップ結合を介した作用であることが判明したことにより、医療経済的にも普及可能で確実な治療効果を有する幹細胞製剤の開発が可能となっています。現在、ギャップ結合を介して移動する水溶性低分子の全容解明、幹細胞懸濁液に混入するギャップ結合の阻害因子の同定、幹細胞機能を向上する物質の探索、幹細胞機能の定量的評価方法の確立など、最適化した幹細胞治療製剤の産業化に向けた研究開発を行っています。 - ②幹細胞治療を代替する再生医療の開発
幹細胞治療の作用機序が判明したことにより、その作用の代替物を使った再生医療が可能であると考えています。現在、幹細胞治療の作用を代替する低分子化合物・生体分子の探索、および機能性リポソームの構築を国内外の研究機関と共同で実施しています。
認知症に対する再生医療の確立
(1)これまでの成果
- ・単純加齢マウスへの幹細胞投与による神経機能再生効果
単純加齢マウスは、認知機能の低下とともに、運動能力・筋肉量・免疫能力・創傷治癒能力の低下などが観察されるため、ヒト認知症患者の病態を正確に反映するモデルマウスであると考えられています。私たちは、単純加齢マウスへの造血幹細胞投与を行い、幹細胞投与が認知機能を担っている海馬での神経再生を活性化し(図6)、認知機能を向上することを、世界に先駆けて発見報告しました(Takeuchi et al. Front Aging Neurosci. 2020、Takeuchi et al. Front Aging Neurosci. 2022)。 - ・加齢に伴うギャップ結合を介した作用の低下と幹細胞によるその活性化を発見
単純加齢マウスの海馬や末梢血中を循環している白血球細胞、継代培養を重ねた血管内皮細胞等において、ギャップ結合タンパク発現が低下し細胞-細胞相互作用も低下していること、および幹細胞がギャップ結合タンパクの発現を増加させることを発見報告しました(Takeuchi et al. Front Aging Neurosci. 2022)。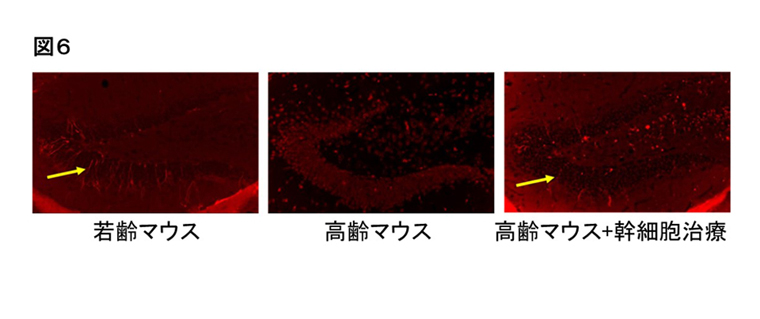
- 図6.幹細胞治療による海馬神経再生の活性化(海馬神経再生により生み出された新生ニューロンの一つを黄色矢印で示す)
- 若齢マウスでは非常に多くの新生ニューロンが観察されるが、高齢マウスではほとんど観察されない。一方、幹細胞治療により短期記憶が向上した高齢マウスでは、多くの新生ニューロンが観察されます(Front Aging Neurosci. 2022より引用/改変)。
(2)研究の内容
- ①海馬神経再生をターゲットにした治療法開発
認知症患者で最も問題となる症状は短期記憶の障害であり、短期記憶を担当する細胞は海馬神経再生により生み出される新生ニューロンであることが、最近の研究で判明しています。さらに、同年代の正常者と比べて、認知症患者では海馬神経再生が激減していることが知られており、私たちは認知症に対する合理的な治療ターゲットは、海馬神経再生であると考えています(図7)。現在、幹細胞治療による脳血管の活性化が神経再生を促進する機序の解明も着々と進んでおり、その作用機序に基づく海馬神経再生をターゲットにした幹細胞や代替物を用いた治療法開発を行っています。 - ②加齢の本質の解明
認知症は典型的な加齢に伴う疾患であり、認知症に対する確実な治療法の普及には、加齢の本質の解明も重要であると考えています。多細胞生物の特徴である細胞-細胞相互作用の中で、非常に強力でかつ直接的な作用を持つギャップ結合を介した細胞-細胞相互作用が、加齢に伴い低下すること、および幹細胞による再生でその作用が向上し神経再生も活性化することにより、ギャップ結合を介した細胞-細胞相互作用が多細胞生物における加齢に非常に大きな影響を有していると考えています。加齢とは視点を変えると正反対の現象である幹細胞による再生の作用機序の解明を起点として、ギャップ結合の観点からの加齢の本質解明につながる研究を行なっています。
- 図7.認知症に対する全く新しい視点からの治療法開発
- 幹細胞治療による脳血管の活性化が神経再生を促進する機序の解明も進んでおり、再生医療を応用した認知症治療を進めています。
業績
- Nabetani M, Mukai T, Taguchi A. Cell therapies for autism spectrum disorder based on new pathophysiology: A review. Cell Transplant. 2023 Jan-Dec;32:9636897231163217.
- Nakano-Doi A, Kubo S, Sonoda E, Taguchi A, Nakagomi T. Different contacted cell types contribute to acquiring different properties in brain microglial cells upon intercellular interaction. Int J Mol Sci.2023 Jan 16;24(2):1774. doi: 10.3390/ijms24021774.
- Ogawa Y, Akamatsu R, Fuchizaki A, Yasui K, Saino O, Tanaka M, Kikuchi-Taura A, Kimura T, Taguchi A. Gap junction-mediated transport of metabolites between stem cells and vascular endothelial cells. Cell Transplant. 2022 Jan-Dec;31:9636897221136151. doi: 10.1177/09636897221136151.
- Ogawa Y, Okinaka Y, Kikuchi-Taura A, Saino O, Tani-Yokoyama A, Masuda S, Komatsu-Horii M, Ikemoto Y, Kawamoto A, Fukushima M, Taguchi A. Pre-clinical proof of concept: Intra-carotid injection of autologous CD34 positive cells for chronic ischemic stroke, Front Med, 2022. Mar 11;9:681316. doi: 10.3389/fmed.2022.681316.
- Takeuchi Y, Saino O, Okinaka Y, Ogawa Y, Akamatsu R, Kikuchi-Taura A, Kataoka Y, Maeda M, Gul S, Claussen C, Boltze J, Taguchi A. Increased RNA transcription of energy source transporters in circulating white blood cells of aged mice. Front Aging 2022. Feb 3;14:759159. doi: 10.3389/fnagi.2022.759159.
- Okamoto T, Park EJ, Kawamoto E, Usuda H, Wada K, Taguchi A, Shimaoka M. Endothelial connexin-integrin crosstalk in vascular inflammation. Biochim Biophys Acta Mol Basis Dis. 2021;1867(9):166168.
- Ogawa Y, Saino O, Okinaka Y, Takeuchi Y, Saino O, Kikuchi-Taura A, Taguchi A. Bone Marrow Mononuclear Cells Transplantation and Training increased transplantation of energy source transporters in chronic stroke, JSCVD, 2021. Jun 17;30(8):105932. doi: 10.1016/j.jstrokecerebrovasdis.2021.105932.
- Kikuchi-Taura A, Okinaka Y, Saino O, Takeuchi Y, Ogawa Y, Kimura T, Gul S, Claussen C, Boltze J, Taguchi A. Gap junction-mediated cell-cell interaction between transplanted mesenchymal stem cells and vascular endothelium in stroke. Stem Cells. 2021 Mar 11. doi: 10.1002/stem.3360.
- Boltze J, Taguchi A, 他. New Mechanistic Insights, Novel Treatment Paradigms, and Clinical Progress in Cerebrovascular Diseases. Front Aging Neurosci. 2021 Jan 28;13:623751. doi: 10.3389/fnagi.2021.623751.
- Ogawa Y, Okinaka Y, Takeuchi Y, Saino O, Kikuchi-Taura A, Taguchi A. Intravenous Bone Marrow Mononuclear Cells Transplantation Improves the Effect of Training in Chronic Stroke Mice. Front. Med., November 26, 2020. doi: 10.3389/fmed.2020.535902.
- Boltze J, Didwischus N, Li S, Jolkkonen J, Taguchi A. Increased migratory and Homing abilities of neural and mesenchymal stem cell populations by transient cell modifications: Preclinical progress and clinical relevance. EBioMedicine. 2020 Sep 24;60:103022. doi: 10.1016/j.ebiom.2020.103022.
- Takeuchi Y, Okinaka Y, Ogawa Y, Kikuchi-Taura A, Kataoka Y, Gul S, Claussen C, Boltze J, Taguchi A. Intravenous Bone Marrow Mononuclear Cells Transplantation in Aged Mice Increases Transcription of Glucose Transporter 1 and Na+/K+-ATPase at Hippocampus Followed by Restored Neurological Functions. Front. Aging, June 11, 2020. doi: 10.3389/fnagi.2020.00170.
- Kikuchi-Taura A, Okinaka Y, Takeuchi Y, Ogawa Y, Maeda M, Kataoka Y, Yasui T, Kimura T, Gul S, Claussen C, Boltze J, Taguchi A. Bone marrow mononuclear cells activate angiogenesis via gap junction mediated cell-cell interaction. Stroke. 2020.51(4):1279-1289. doi: 10.1161/STROKEAHA.119.028072.
日本語総説
- 小川優子、田口明彦、『脳梗塞再生医療の進歩』、医学のあゆみ、280(10), 1099-1103 (2022).
- 田口明彦、小川優子、『幹細胞治療における脳血管内皮細胞』、最新臨床脳卒中学(第2版)、80、639-643(2022)
- 田口 明彦 脳卒中に対する再生医療. 理学療法ジャーナル 2017;51(5):451-456
- 田口 明彦. 脳卒中患者に対する細胞治療. 医学のあゆみ. 2017;260(7):563-567
- 田口 明彦. 脳卒中に対する再生医療. PTジャーナル. 2017; 51(5):451-456
- 田口 明彦. 脳卒中の再生医療. Medicina. 2016;53(2):340-342
- 田口 明彦. 脳卒中とバイオマーカー:新たな展開 末梢血中造血幹細胞数. 分子脳血管病. 2016;15(2):17-21
- 田口 明彦. 脳梗塞に対する自己骨髄単核球細胞治療. Clinical Neuroscience. 2016;34(11):1261-1262
近年の主な受賞歴
- 小川優子『再生医療用、他家造血幹細胞製剤の開発』第64回日本脳循環代謝学会優秀演題賞
-
Access交通アクセス
〒650-0047 神戸市中央区港島南町2-2
先端医療センター(IBRI)内5F View More



