先端医療研究センター免疫機構研究部
NEWS
-
01.13.2023
-
The article "Anti-PD-1 antibodies recognizing the membrane-proximal region are PD-1 agonists that can downregulate inflammatory diseases"
was published in Science Immunology.
Full text available [Dept of Immunology's English page]
研究内容
免疫学研究は人々の健康な生活のために
免疫系の不調は非常に多岐にわたる疾患を引き起こします。我々の研究目的は、免疫系の活性を適切なレベルに是正することによって、多種多様な疾患の治療に結びつけることです。免疫のシステムの中には免疫反応の強度を抑制するメカニズムが備わっており、その働きを人為的に向上させることができれば、過剰な免疫反応を抑制して数々の炎症性疾患の症状を改善できるものと期待されます。また、炎症性疾患を発症するリスクについて早い段階で把握することができれば、治療方針の決定において重要な情報をもたらすことができます。そのために我々は炎症性の変化を早期に検知するのに役立つマーカーの探索を行っています。

免疫機構研究部長太田 明夫(おおた・あきお)

- 研究内容
- 業 績
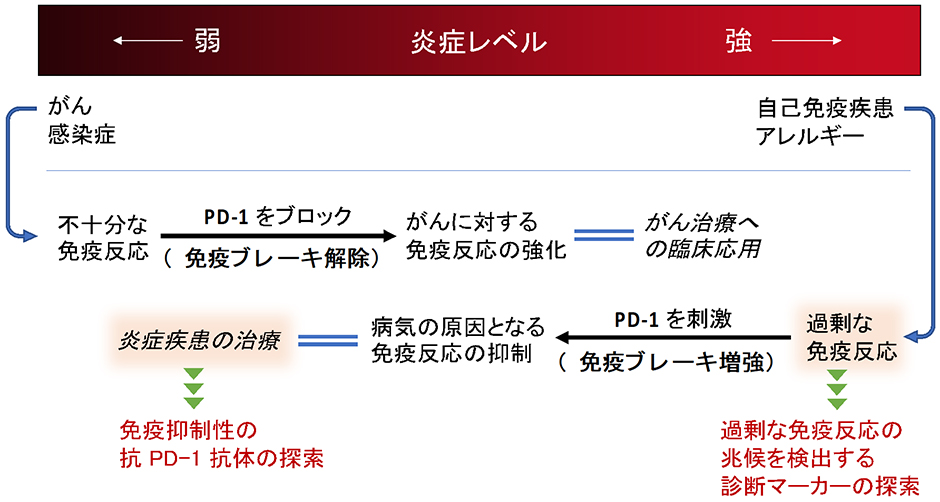
生体内の免疫システムには多様な活性化メカニズムや抑制メカニズムが備わっており、免疫反応のタイプや強度はこれらによる制御を受けています。しかし、時にその制御は完全ではなく、免疫反応が不十分であれば細菌、ウイルスなどの病原体やがん細胞の増殖を許してしまう危険性が増します。反対に、免疫細胞の不必要なまでの活性化はアレルギー性疾患、自己免疫疾患を含む数々の炎症性疾患の原因となります。
PD-1は、免疫システム中の抑制メカニズムの中でも影響力の強いものの一つです。PD-1を欠損するマウスが各種の炎症性疾患を自然発症してしまうことに示されるように、このメカニズムによって無用な炎症反応は抑制されています。普段はそれを発現している細胞があまり見られないPD-1ですが、活性化した免疫細胞において発現レベルが増加します。このことは、PD-1が炎症反応を抑制する生理的なフィードバック機構として機能していることを示唆しています。実際に、がん組織もこのような免疫調節メカニズムを利用してがんに対する免疫応答を抑えており、抗PD-1抗体に代表される医薬品は免疫抑制を解除する新しいがん治療法として好成績を挙げています。
がん治療の場合とは逆に、炎症性疾患の治療には、生体内の免疫抑制メカニズムを積極利用する戦略が有望です。我々はPD-1の免疫抑制活性を誘導する抗体医薬の研究を行っています。がん治療に用いられている抗PD-1抗体はPD-1の活性を遮断するブロッキング抗体ですが、我々が目的とするアゴニスト抗体は逆に細胞内シグナルを増強する抗体です。そのような目的にかなう抗体を探索するために、我々は抗PD-1抗体添加によって誘導される生物活性を検出する実験システムを樹立し、抗ヒトPD-1モノクローナル抗体のスクリーニングを行いました。その結果、ブロッキング抗体に混じって、免疫抑制活性を刺激できる抗体をいくつも見出しました。これらのアゴニスト抗体は、ヒトのT細胞に対して抑制活性を示すことも確認されました。
この抗PD-1アゴニスト抗体が実際の炎症疾患に対して効果を示すかどうか、ヒトPD-1のノックインマウスを使用して検討を行ったところ、いくつもの炎症モデルにおいてその抗炎症作用が明確でした。PD-1アゴニスト抗体との相性が良好なのはT細胞依存的な免疫反応のようで、これはPD-1を高いレベルで発現する細胞が主にT細胞であることと一致しています。このことから推定すると、PD-1アゴニスト抗体が薬剤として有効性を示す可能性がある疾患には乾癬のような皮膚炎、アレルギー疾患、関節リウマチを含むいくつかの自己免疫疾患といったところが挙げられます。今後は、臨床試験を視野に入れ、我々の取得したPD-1アゴニスト抗体の治療薬としての開発を進めていく予定です。
このように、炎症疾患にはT細胞が関わっていることが結構あり、特定の抗原に対するT細胞の反応が疾患の根源となっている場合があります。また、ウイルス感染などにおいても、T細胞によるウイルス抗原の認識が疾患の転帰に重要な意味を持っています。さらに、がんの免疫治療の際に誘導される炎症性の病変においてもT細胞の活性は中心的な役割を持っています。これらの疾患における感受性、抵抗性といったものは個々人のT細胞の反応性に反映されると考えられるので、その状態が事前に把握できれば診断、治療に利用価値のあるものに繋がります。我々は、末梢血中のT細胞を使用して、短時間で抗原特異的な細胞を検出することができる方法を見出しており、この方法が過剰な免疫反応が発現する兆候を示す診断マーカーとして適しているか評価を続けております。
発表論文
- Wang, G., Tajima, M., Honjo, T., and Ohta, A. STAT5 interferes with PD-1 transcriptional activation and affects CD8 + T cell sensitivity to PD-1-dependent immunoregulation. Int Immunol 33:563-572 (2021)
- Ashoori, M.D., Suzuki, K., Tokumaru, Y., Ikuta, N., Tajima, M., Honjo, T., and Ohta, A. Inactivation of the PD-1-dependent immunoregulation in mice exacerbates contact hypersensitivity resembling immune-related adverse events. Front Immunol 11:618711 (2021)
- Ohta, A. Oxygen-dependent regulation of immune-checkpoint mechanisms. Int Immunol 30:335-343 (2018)
- Kjaergaard, J., Hatfield, S., Jones, G., Ohta, A., and Sitkovsky, M. A2A Adenosine Receptor Gene Deletion or Synthetic A2A Antagonist Liberate Tumor-Reactive CD8+ T Cells from Tumor-Induced Immunosuppression. J Immunol 201:782-791 (2018)
- Abbott, R.K., Silva, M., Labuda, J., Thayer, M., Cain, D.W., Philbrook, P., Sethumadhavan, S., Hatfield, S., Ohta, A., and Sitkovsky, M. The Gs Protein-coupled A2a Adenosine Receptor Controls T Cell Help in the Germinal Center. J Biol Chem 292:1211-1217 (2017)
- Sethumadhavan, S., Silva, M., Philbrook, P., Nguyen, T., Hatfield, S.M., Ohta, A., and Sitkovsky, M.V. Hypoxia and hypoxia-inducible factor (HIF) downregulate antigen-presenting MHC class I molecules limiting tumor cell recognition by T cells. PLoS One 12:e0187314 (2017)
- Ohta, A. A Metabolic Immune Checkpoint: Adenosine in Tumor Microenvironment. Front Immunol 7:109 (2016)
- Abbott, R.K., Thayer, M., Labuda, J., Silva, M., Philbrook, P., Cain, D.W., Kojima, H., Hatfield, S., Sethumadhavan, S., Ohta, A., Reinherz, E.L., Kelsoe, G., and Sitkovsky, M. Germinal Center Hypoxia Potentiates Immunoglobulin Class Switch Recombination. J Immunol 197:4014-4020 (2016)

